Table des matières
Introduction : Quand la matière se transforme sous vos yeux
Vous êtes-vous déjà demandé pourquoi la glace sèche semble disparaître dans l’air ou pourquoi votre miroir s’embue après une douche chaude ? Ces phénomènes fascinants sont le résultat de changements d’état bien précis : la sublimation et condensation. Ces deux processus opposés illustrent la beauté invisible des sciences physiques qui façonnent notre quotidien.
Ces transformations nous entourent au quotidien, que ce soit dans la nature, en laboratoire ou même dans notre cuisine. Comprendre comment elles fonctionnent, c’est aussi mieux maîtriser certains procédés industriels et scientifiques essentiels. Préparez-vous à plonger dans un voyage captivant au cœur des états de la matière.
Qu’est-ce que la sublimation ? Un passage direct vers l’invisible
Définition
La sublimation est un changement d’état physique par lequel une substance passe directement de l’état solide à gazeux, sans passer par l’état liquide intermédiaire. Ce phénomène se produit lorsque les particules d’un solide acquièrent suffisamment d’énergie pour surmonter les forces qui les maintiennent ensemble, évitant ainsi la phase liquide.
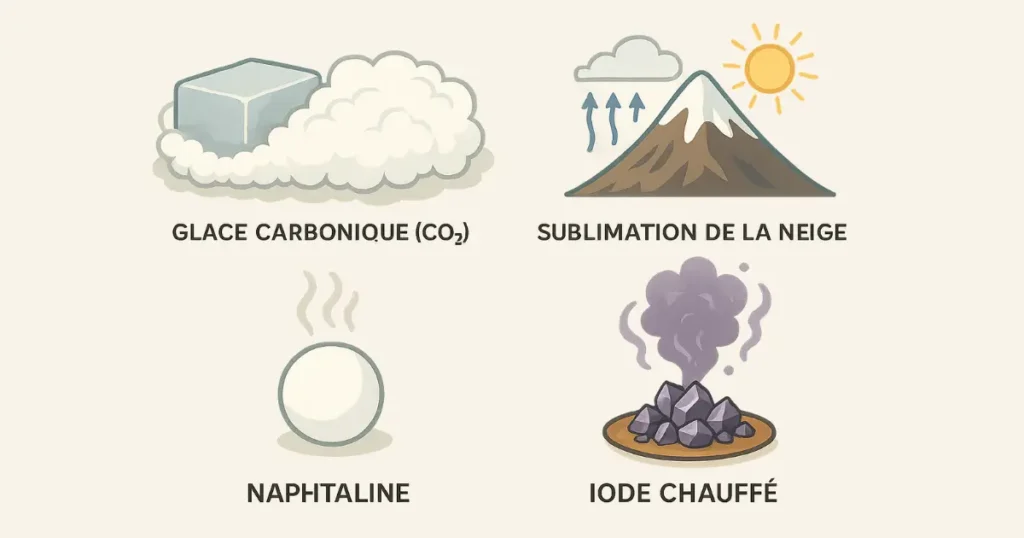
Exemples courants :
- Glace sèche (CO₂ solide) qui s’évapore dans l’air sans se liquéfier.
- Neige qui disparaît sans fondre lors de journées froides mais ensoleillées en haute altitude.
- Camphre qui diminue progressivement à température ambiante.
- Iode chauffé qui se transforme en vapeur violette.
Mécanisme
- Ce processus se produit généralement à basse pression atmosphérique ou à des températures particulières.
- Nécessite une absorption d’énergie thermique suffisante pour briser les liaisons intermoléculaires dans l’état solide.
- C’est un phénomène endothermique : il absorbe de l’énergie.
Substances couramment sublimées
- Dioxyde de carbone (CO₂)
- Iode
- Naphtalène
- Arsenic
Qu’est-ce que la condensation ? Le retour visible du gaz au liquide

Définition
La condensation est un changement d’état au cours duquel une substance passe de l’état gazeux à l’état liquide. Cela survient lorsque la vapeur est refroidie ou compressée, ce qui diminue l’agitation moléculaire et permet aux molécules de se rapprocher suffisamment pour former un liquide.
Exemples fréquents :
- Buée sur les vitres ou les miroirs après une douche chaude.
- Gouttelettes d’eau sur une bouteille froide exposée à l’air chaud.
- Rosée matinale qui se forme sur les plantes.
- Nuages formés par la condensation de vapeur d’eau dans l’atmosphère.
Mécanisme
- Se produit lorsque la température d’un gaz descend en dessous de son point de rosée ou que la pression augmente.
- La vapeur perd alors de l’énergie thermique (phénomène exothermique) et les molécules se rassemblent pour former un liquide.
Types de condensation

- Condensation de surface (ex. : miroir embué)
- Condensation atmosphérique (ex. : formation des nuages)
Tableau comparatif : Sublimation vs Condensation
| Caractéristique | Sublimation | Condensation |
|---|---|---|
| Changement d’état | Solide → Gaz | Gaz → Liquide |
| Énergie | Absorption d’énergie (endothermique) | Libération d’énergie (exothermique) |
| Exemple principal | Glace sèche, iode | Buée, nuages, gouttelettes |
| Conditions typiques | Température spécifique, basse pression | Refroidissement ou compression |
| Passage par liquide | Non | Oui |
| Processus visible | Vapeur formée directement | Gouttelettes visibles |
Applications concrètes dans la vie et l’industrie
Sublimation :
- Impression par sublimation thermique : utilisée pour transférer des images sur des textiles, mugs, objets personnalisés grâce à une encre spéciale qui se sublime.
- Lyophilisation : technique de conservation qui élimine l’eau des aliments ou des médicaments par congélation puis sublimation.
- Nettoyage cryogénique : nettoyage industriel par projection de glace sèche qui se sublime sans laisser de résidu.
- Chimie analytique : purification de certaines substances par sublimation.
Condensation :
- Systèmes de climatisation : condensation du réfrigérant dans les circuits fermés pour évacuer la chaleur.
- Production d’eau potable : dispositifs atmosphériques capturant l’humidité de l’air et la condensant en eau.
- Distillation : processus chimique utilisant la condensation pour séparer les composants.
- Formation météorologique : nuages, rosée, brouillard, pluie proviennent tous de la condensation atmosphérique.
Quiz : Testez vos connaissances
- La sublimation nécessite :
- A) Une baisse de température
- B) Une augmentation de pression
- C) L’absorption de chaleur
- La condensation est un processus :
- A) Endothermique
- B) Exothermique
- C) Neutre
- La buée sur une vitre est un exemple de :
- A) Sublimation
- B) Condensation
- C) Fusion
- Quel élément peut sublimer facilement ?
- A) Eau
- B) Iode
- C) Éthanol
- La condensation atmosphérique est responsable de :
- A) La neige
- B) Les éclairs
- C) Les nuages
✅ Réponses du quiz
La condensation atmosphérique est responsable de :
C) Les nuages
La sublimation nécessite :
C) L’absorption de chaleur
La condensation est un processus :
B) Exothermique
La buée sur une vitre est un exemple de :
B) Condensation
Quel élément peut sublimer facilement ?
B) Iode
FAQ – Foire Aux Questions
La sublimation est-elle un phénomène naturel ?
Oui, elle peut se produire naturellement, comme avec la neige en montagne exposée au soleil, surtout en conditions de basse pression atmosphérique.
Peut-on inverser la condensation ?
Oui, en chauffant un liquide, on provoque l’évaporation. Cette opération est l’inverse exact de la condensation.
Est-ce que tous les solides peuvent sublimer ?
Non, seuls certains solides ayant des propriétés physico-chimiques spécifiques sont capables de sublimer à pression atmosphérique normale.
Quelle est la différence entre sublimation et évaporation ?
L’évaporation se produit à la surface d’un liquide, alors que la sublimation intervient à l’état solide sans phase liquide intermédiaire.
Quel est le rôle de la pression dans ces phénomènes ?
La pression influence fortement les températures auxquelles se produisent les changements d’état. À basse pression, la sublimation est favorisée ; à haute pression, la condensation est plus facile.
📌 Résumé des points clés
- Sublimation : changement d’état direct du solide au gaz, sans passer par le liquide. Processus endothermique, visible avec la glace sèche, l’iode ou le camphre.
- Condensation : passage du gaz au liquide par refroidissement ou compression. Processus exothermique, présent dans la buée, les nuages ou la rosée.
- Tableau comparatif : permet de visualiser les différences fondamentales entre ces deux transformations.
- Applications concrètes : de l’impression textile à la production d’eau potable, ces phénomènes sont exploités dans de nombreux domaines scientifiques et industriels.
- Quiz & FAQ : des outils pédagogiques pour mieux comprendre et mémoriser les concepts abordés.
Conclusion : Sublimation et Condensation, deux processus opposés, un même émerveillement
La sublimation et la condensation sont deux facettes essentielles des transitions de phase de la matière. L’une transforme le solide en gaz de manière spectaculaire et silencieuse, l’autre révèle la présence de l’humidité ambiante par la formation de liquide. Ces transformations sont omniprésentes, aussi bien dans les phénomènes naturels que dans les technologies modernes.
En maîtrisant ces concepts, nous pouvons non seulement mieux comprendre les phénomènes du quotidien, mais aussi les exploiter dans l’industrie, la recherche scientifique, et l’innovation technologique.







