Table des matières
Introduction : Comment ça marche une allumette
Craquer une allumette pour allumer une bougie, un feu de camp ou un poêle semble être un acte anodin, tellement intégré à notre quotidien que nous n’y prêtons plus attention. Pourtant, ce geste cache une fascinante alchimie entre chimie, physique, frottement et une bonne dose d’ingéniosité humaine. D’où vient cette flamme instantanée ? Que renferme réellement ce minuscule bâtonnet en bois ou en carton ? Pourquoi le simple frottement produit-il une flamme ? Embarquons pour une exploration passionnante de la science cachée derrière chaque allumette craquée.
Un cocktail chimique bien pensé : de quoi est faite une allumette ?
Derrière la simplicité apparente d’une allumette se cache une formule chimique élaborée, pensée pour réagir rapidement mais de manière contrôlée. La tête de l’allumette concentre des substances choisies pour leur rôle spécifique dans la combustion.
Composition classique d’une allumette dite « de sûreté » :
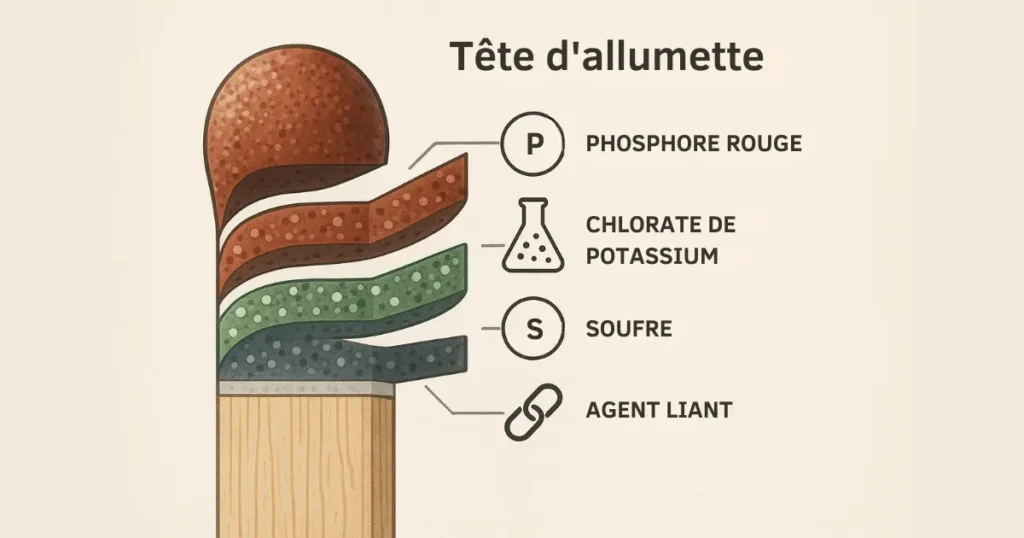
| Élément | Rôle dans la réaction |
|---|---|
| Phosphore rouge | Réagit par frottement, amorce la combustion |
| Chlorate de potassium (KClO₃) | Fournit l’oxygène pour maintenir la flamme |
| Soufre | Brûle facilement, prolonge la combustion |
| Agents liants | Maintiennent les composants ensemble |
| Colorants | Esthétiques, sans rôle chimique essentiel |
⬆️ Le grattoir, situé sur le côté de la boîte, contient également du phosphore rouge, des abrasifs comme la silice (verre pilé) et parfois des charges minérales pour favoriser un frottement efficace. Ce dispositif ingénieux permet de conserver une séparation sécurisée entre les composants réactifs.
Certaines allumettes, dites « universelles », peuvent s’allumer sur n’importe quelle surface rugueuse grâce à l’inclusion de phosphore directement dans la tête, mais elles sont beaucoup moins sûres.
La magie du frottement : déclencheur de la réaction

La combustion d’une allumette ne peut démarrer que grâce à une source d’énergie initiale : c’est là que le frottement intervient. Ce geste rapide mais précis libère une chaleur localisée intense. Lorsqu’on frotte la tête sur le grattoir, plusieurs réactions s’enchaînent :
- Le phosphore rouge est converti localement en phosphore blanc, très instable et inflammable.
- Cette transformation génère une montée de chaleur suffisante pour déclencher la décomposition du chlorate de potassium.
- Ce dernier libère alors de l’oxygène, un comburant qui alimente la combustion du soufre, puis du bois ou carton.
🔥 Résultat : une flamme vive et maîtrisée, capable d’enflammer rapidement d’autres matériaux.
👉 Cette séquence rapide et spectaculaire est un bel exemple de réaction en chaîne chimique, déclenchée par une simple action mécanique : le frottement.
Un peu d’histoire : l’allumette, une invention révolutionnaire
L’idée d’allumer un feu facilement remonte à des millénaires, mais l’allumette moderne est relativement récente. Retour sur ses étapes clés :
- Avant 1800 : le feu était produit par percussion (silex, pyrite), friction (bois contre bois) ou focalisation solaire.
- 1826 : L’anglais John Walker invente la première allumette par frottement, appelée « friction match », à base de sulfure d’antimoine et chlorate de potassium.
- 1830s : Introduction des allumettes au phosphore blanc, très efficaces mais hautement toxiques et dangereuses pour les ouvriers des usines.
- 1898 : Découverte du phosphore rouge, non toxique, par Anton von Schrötter.
- Début XXe siècle : Diffusion massive des allumettes de sûreté, où le phosphore est déplacé dans le grattoir.
Aujourd’hui encore, cette invention vieille de plus d’un siècle reste indispensable dans de nombreux contextes, du camping à la cuisine.
Pourquoi l’allumette ne s’allume-t-elle que sur la boîte ?
Le secret de cette sécurité réside dans la séparation des composants actifs. L’allumette seule, sans sa boîte, ne peut pas produire de flamme par simple choc ou pression.
- La tête contient des agents comburants (comme le chlorate) et du soufre.
- Le grattoir contient le phosphore rouge, nécessaire au déclenchement.
Sans le frottement spécifique entre ces deux éléments, aucune réaction n’est possible.
✅ Ce système permet de réduire drastiquement les risques d’allumage accidentel, rendant l’allumette de sûreté particulièrement fiable et idéale pour un usage domestique ou scolaire.
Quiz : Que savez-vous sur les allumettes ?
- Quelle est la principale substance responsable de l’allumage ?
- a) Soufre
- b) Phosphore rouge
- c) Chlorate de potassium
- Quel élément fournit l’oxygène nécessaire à la combustion ?
- a) Air
- b) Soufre
- c) Chlorate de potassium
- Quelle innovation rend les allumettes « de sûreté » si sûres ?
- a) Bois traité
- b) Grattoir séparé contenant du phosphore
- c) Absence de soufre
- Quel est le rôle du frottement dans l’allumage ?
- a) Décore l’allumette
- b) Produit une étincelle décorative
- c) Génère la chaleur qui déclenche la réaction chimique
📌 Réponses
1-b, 2-c, 3-b, 4-c
FAQ : Questions fréquentes sur les allumettes
Peut-on allumer une allumette sans grattoir ?
Oui, dans certains cas. Une surface rugueuse comme un mur en béton ou une pierre abrasive peut générer un frottement suffisant. Cependant, cela reste moins fiable et moins sécurisé.
Les allumettes sont-elles dangereuses pour l’environnement ?
Comparées aux briquets jetables en plastique, les allumettes en bois certifié (FSC) ont un impact écologique plus faible. Les anciennes versions au phosphore blanc étaient dangereuses, mais les modèles actuels sont bien plus sûrs.
Pourquoi certaines allumettes ont-elles une tête colorée ?
Les colorants ajoutés n’ont qu’un rôle esthétique ou de différenciation de marque. Ils n’interfèrent pas avec la combustion.
Pourquoi les allumettes ne s’allument pas toutes seules dans la poche ?
Grâce au principe de frottement contrôlé, l’allumette de sûreté nécessite une surface spécifique et un angle précis d’attaque pour produire la chaleur nécessaire à l’allumage.
✅ Résumé des points clés
- Allumer une allumette, c’est déclencher une réaction chimique rapide grâce à un simple frottement.
- La tête de l’allumette contient : du phosphore rouge, du chlorate de potassium, du soufre, des liants et des colorants.
- Le grattoir sur la boîte contient également du phosphore rouge et des abrasifs pour favoriser la chaleur due au frottement.
- Ce frottement convertit le phosphore rouge en phosphore blanc, qui déclenche une réaction en chaîne aboutissant à l’apparition de la flamme.
- Les allumettes de sûreté sont conçues pour ne fonctionner que sur leur boîte, évitant les allumages accidentels.
- Historiquement, l’invention des allumettes a évolué : de solutions dangereuses au phosphore blanc à l’option plus sûre avec le phosphore rouge.
- Le principe de séparation des composants est essentiel à la sécurité.
- L’allumette est un parfait exemple de science appliquée dans le quotidien.
Conclusion : Une étincelle de science dans le quotidien
La prochaine fois que vous allumerez une allumette, souvenez-vous que vous réalisez un véritable phénomène scientifique à petite échelle. Ce geste rapide ne consiste pas simplement à faire apparaître une flamme, mais à activer une série de réactions chimiques parfaitement orchestrées. Le frottement appliqué déclenche une élévation de température qui transforme le phosphore rouge, ce qui lance la combustion grâce à l’oxygène libéré par le chlorate de potassium.
Ce petit bâtonnet en apparence anodin met donc en œuvre plusieurs branches des sciences : la chimie, la thermodynamique, la sécurité des matériaux, et même la mécanique des surfaces. L’allumette est un parfait exemple de technologie discrète et maîtrisée, mise au point pour un usage quotidien en toute sécurité.
Sous son apparente simplicité, elle symbolise l’ingéniosité humaine : rendre accessible, pratique et sûr un processus aussi fondamental que la création du feu. Pas étonnant qu’elle continue d’éveiller la curiosité des esprits scientifiques et des amateurs de découvertes techniques.







